Wildtiere als Reservoir und Sentinels für Tierseuchen- und -Zoonoseerreger
Aus der Abteilung II (Abteilungsleiter: Oberfeldveterinär Dr. N. Langfeldt) des 1Zentralen Instituts des Sanitätsdienstes der Bundeswehr Kiel (Leiter: Oberstveterinär Dr. H.-H. Pott), dem 2Institut für Virusdiagnostik des Friedrich-Loeffler-Institutes, Greifswald Insel Riems (Leiter: Prof. Dr. M. Beer) und dem 3Institut für Lebensmittelqualität und -sicherheit (Direktor: Oberstveterinär d. R. Prof. Dr. G. Klein) der Stiftung Tierärzt-liche Hochschule Hannover.
U. Schotte
Zusammenfassung
Nicht nur Infektionskrankheiten im Allgemeinen, sondern auch die „Emerging Infectious Diseases“ (EID) sind von hoher Bedeutung für die öffentliche Gesundheit von Mensch und Tier und können damit unmittelbare Auswirkungen auf die Auftragserfüllung haben. Wildtiere dienen hier häufig als Reservoir von Zoonosen und Tierseuchen, ohne immer selbst zu erkranken. Am Zentralen Institut des Sanitätsdienstes der Bundeswehr Kiel wurde seit 2001 zunehmend das Monitoring auf Tierseuchen- und Zoonoseerreger bei jagdbaren Wildtieren auf ausgewählten Truppenübungsplätzen der Bundeswehr etabliert. Es ermöglicht neben der Wahrnehmung hoheitlicher Aufgaben im Rahmen des Schweinepestmonitorings auch Untersuchungen zu Vektor-- oder Lebensmittelübertragbaren Infektionserregern. Die hierzu etablierten robusten Probenahme- und Untersuchungsmethoden können jederzeit an den Bedarf im Einsatz angepasst werden. Durch die Erweiterung der Monitoringuntersuchungen konnten vielfältige Synergie-Effekte erzielt werden, um gleichzeitig robuste und feldtaugliche Nachweismethoden zu etablieren. Die labordiagnostisch gesicherte Erfassung des Erregervorkommens kann vorkommende Risiken unmittelbar verifizieren und ermöglicht -darauf aufbauend die Empfehlung gezielter Präventionsmaß-nahmen.
Schlüsselworte: Wildtiere, Tierseuchen, Zoonosen, Schmallenberg-Virus, Klassische Schweinepest, Afrikanische Schweinepest, Hepatitis E-Virus
Keywords: wild animals, animal diseases, zoonosis, Schmal-lenberg Virus, Classical Swine Fever, African Swine Fever, Hepatitis E-Virus
Einleitung
Infektionskrankheiten, und hier insbesondere die „Emerging Infectious Diseases“ (EID), sind von hoher Bedeutung für die öffentliche Gesundheit von Mensch und Tier. Nahezu Dreiviertel der derzeit bekannten EID sind Zoonoseerreger [15], wobei insbesondere Wildtiere zunehmend von Bedeutung sind [8]. Wildtiere sind außerdem Reservoir für nicht zoonotische Tierseuchenerreger mit hoher wirtschaftlicher Bedeutung [3]. Am Zentralen Institut des Sanitätsdienstes der Bundeswehr Kiel (ZInstSanBw Kiel) wurde mit der Aufstellung der Laborgruppe „Spezielle Tierseuchen- und Zoonosendiagnostik“ in Zusammenarbeit mit der Bundesforst das Monitoring für in der Wildtierpopulation bedeutsame Tierseuchen- und Zoonoseerreger zunächst im Raum Bergen (Niedersachsen) auf dem -NATO-- Truppenübungsplatz eingeführt. Die im Januar 2014 in der Europäischen Union ausgebrochene Afrikanische Schweinepest führte zu einer Ausweitung des Monitorings auf weitere Übungsplätze in den östlichen Bundesländern. Die damit verbundenen Probenahmen wurden nicht nur bei Schwarzwild, sondern auch bei Wildwiederkäuern durchgeführt, um gleichzeitig weitere Tierseuchen- und Zoonoseerreger einzubeziehen. Hierbei stehen aktuell in Deutschland relevante Infektionserreger im Fokus. Die eingesetzten Methoden können jederzeit bei Bedarf an die Anforderungen für die veterinärmedizinische Diagnostik im Einsatz angepasst werden.
Arthropod-borne Diseases
Bunyaviridae
Bunyaviren sind behüllte RNA-Viren mit einem segmentierten, negativ-polarisierten Genom. Die Übertragung erfolgt vornehmlich durch Stechmücken, wobei je nach Region Haus- und Wildwiederkäuer als Erregerreservoir fungieren. Ein prominenter Vertreter dieser Virusfamilie ist das Rift Valley Fever-Virus (RVFV), dessen ursprüngliches Verbreitungsgebiet südlich der Sahara liegt. Bedingt durch vermehrten Tierhandel und den Export lebender Tiere führte das RVFV in der Vergangenheit wiederholt in Nord- und Westafrika, aber auch auf der arabischen Halbinsel und auf Madagaskar zu Ausbrüchen [13]. Mittlerweile darf angenommen werden, dass das Virus in der dortigen Wiederkäuerpopulation endemisch ist. Das RVFV wird vornehmlich durch Stechmücken der Gattung Aedes übertragen, aber auch Culex und Anopheles wurden als Vektor beschrieben. Das große Vektorenspektrum zeigt das hohe Ausbreitungspotenzial, verbunden mit der festen Etablierung in ursprünglich naiven Regionen [13].
In Deutschland wurde in 2011 mit dem Schmallenberg-Virus (SBV) ein bisher unbekanntes Orthobunya-Virus bei Rindern nachgewiesen [7], das im weiteren Verlauf allein in Deutschland zu über 2 000 Ausbrüchen in Rinder-, aber auch Schafbeständen führte. Die Übertragung erfolgt vornehmlich durch in Mitteleuropa weit verbreitete Gnitzenarten der Gattung Culicoides, eine vertikale Übertragung durch infizierte Bullensamen wurde in Einzelfällen beschrieben [7]. Betroffen sind vornehmlich Rinder, Schafe und Ziegen aber auch diverse Wildwiederkäuer. Abgesehen von den Missbildungen infizierter neugeborener Kälber bzw. Lämmer sind die klinischen Erscheinungen eher unauffällig. Nach der schnellen Ausbreitung in 2012 nahm die Zahl der akuten Ausbrüche in 2013 deutlich ab. Die erfolgreiche ganzjährige Etablierung des Erregers in Deutschland zeigte sich durch den erneuten Anstieg bei Neuausbrüchen in 2014 [14].
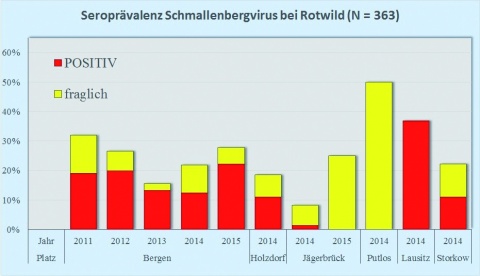
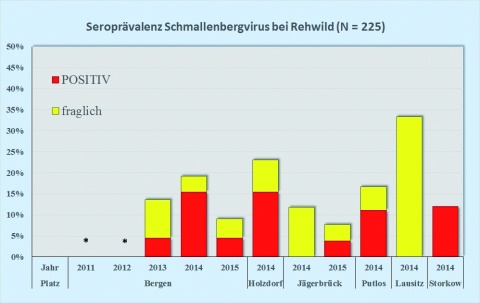
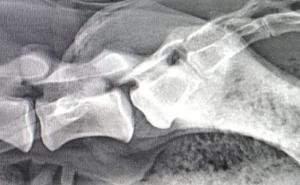
Die Seroprävalenz des SBV zeigte auch bei Wildwiederkäuerpopulationen der Standort- und Truppenübungsplätze eine leichte Zunahme bei Reh-, Rot- und Damwild im Raum Bergen von 2013 auf 2014 (Abbildung 1), der bei Rotwild auch für Anfang 2015 anhielt (Abbildung 1 oben). Die Übungsplätze Holzdorf, Storkow und Oberlausitz wurden 2014 erstmals in das Monitoring einbezogen, daher kann trotz teilweise höherer Seroprävalenzen noch keine Tendenz abgelesen werden.
Hochkontagiöse Tierseuchen
Schweinepest
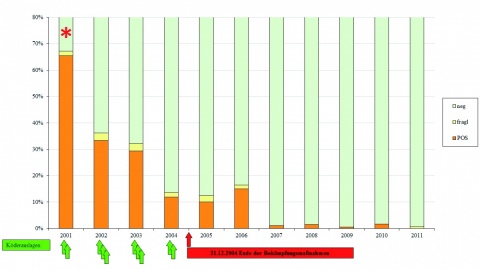
Die Klassische Schweinepest (KSP) trat in Deutschland zuletzt 2006 in Hausschweinen (Borken, Nordrhein-Westfalen) und 2009 in Wildschweinen (Rheinland-Pfalz und Nordrhein-Westfalen) auf. Norddeutschland war letztmalig 2001 betroffen. Der dortige Ausbruch wurde nach erfolgreicher Bekämpfung der Tierseuche durch Auslage von Impfködern, verstärkte Bejagung und weitreichende Hygienemaßnahmen beim Umgang mit erlegtem Wild zum 31.12.2004 durch die zuständigen Stellen der EU-Kommission und sich anschließende nationale Regelungen für
erloschen erklärt. Alle Maßnahmen erfolgten in enger Zusammenarbeit von zuständigen Stellen der Bundeswehr und Bundesforst. Im Nachgang wurde auf dem Truppenübungsplatz Bergen mit dem für den Betrieb zuständigen Bundesforstbetrieb das Monitoring weitergeführt. Hierzu wurden die im Rahmen der großen Drück- bzw. Gesellschaftsjagden erlegten Wildschweine durch die Laborgruppe Tierseuchen- und Zoonosendiagnostik des ZInstSanBw Kiel beprobt und serologisch sowie molekularbiologisch auf die KSP untersucht. Dieses Monitoring wurde ab 2012 auf Putlos und Jägerbrück ausgedehnt. Im Zuge des Ausbruchs der Afrikanischen Schweinepest (ASP) in Polen und im Baltikum ab Januar 2014 erfolgte in Absprache mit der zuständigen Überwachungsstelle und den Bundesforstbetrieben eine weitere Ausdehnung auf die Übungsplätze Storkow, Holzdorf und Oberlausitz. Ziel der risikoorientierten Auswahl der Übungsplätze war zum einen die Grenznähe nach Polen (Ausbrüche der ASP seit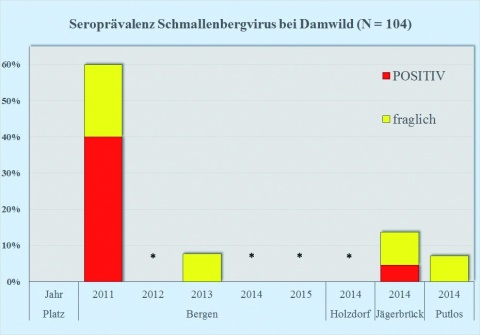
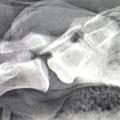
Methodisch erfolgt die Untersuchung mit Hilfe der durch das Friedrich Loeffler-Institut (FLI) gem. §11 Tiergesundheitsgesetz zugelassenen Diagnostika oder entsprechend der Vorgaben der amtlichen Methodensammlung für anzeigepflichtige Tierseuchen [4, 5]. Seit Tilgung der Klassischen Schweinepest in 2004 im Raum Bergen trat die Erkrankung nicht mehr auf den Übungsplätzen der Bundeswehr auf. In den Folgejahren wurde ein schneller Abfall der impfbedingten Seroprävalenzen bei den erlegten Wildschweinen festgestellt, ohne dass erneute Virusnachweise erfolgten (Abbildung 2). Einzelne serologisch positive, aber weiterhin Virus-negative Tiere in den Folgejahren konnten nicht mittels Virus-Neutralisationstest als KSP-Feldvirusinfektion bestätigt werden.
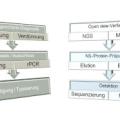
Durch die in der EU deutlich veränderte Situation mit dem Ausbruch der ASP in den östlichen Mitgliedsstaaten wurde nicht nur im zivilen Bereich, sondern auch bei der Bundeswehr die Diagnostik angepasst und um schnelle, hochspezifische und -sensitive molekulare Nachweissysteme erweitert, Beschränkte sich der Umfang der zu untersuchenden Tiere anfangs auf die Stücke der großen Gesellschaftsjagden, so wurde schnell deutlich, dass Fall- und Unfallwild die Hauptrisikogruppen darstellen. Die Bergung und Beprobung von Fallwild stellt jedoch aus Gründen der Verwesung sowie durch Wildfrass eine große Herausforderung dar. Um die Probenahme deutlich zu erleichtern, wurde in Zusammenarbeit mit dem Nationalen Referenzlabor für Schweinepest am FLI die Entnahme von Bluttupfern als einfache und sehr robuste Methode zur Ausschlussdiagnostik für ASP und KSP mittels real-time (RT)-PCR validiert (Abbildung 3) [10]. Auch wenn geringe Sensitivitätsverluste im Vergleich zur Untersuchung von Blut- und Organproben in der Standard-PCR hinzunehmen sind, ist sie doch ausreichend empfindlich, um ASP oder KSP als Todesursache bzw. Erkrankung des Tieres sicher ausschließen zu können.
Virale Lebensmittel-bedingte Zoonosen
Hepatitis E
Das Hepatitis E-Virus (HEV) stellt weltweit die häufigste Ursache viraler Hepatitiden beim Menschen dar, wobei wiederholt Ausbrüche mit bis zu mehreren Tausend Erkrankten in Regionen mit niedrigen hygienischen Standards auftreten [9]. Während die Genotypen 1 und 2 nahezu ausschließlich beim Menschen vorkommen und vorwiegend fäkal-oral übertragen werden, sind die Genotypen 3 und 4 klassische Zoonoseerreger. Als Reservoir für die Genotypen 3 und 4 wurden zunächst Hausschweine, dann aber auch Wildschweine identifiziert. Der Verzehr von nicht ausreichend erhitztem Schweinefleisch, aber auch von Roh- und Leberwürsten, stellt hierbei vermutlich die Hauptinfektionsquelle dar. Die steigende Zahl der an das Robert Koch-Institut gemeldeten HEV--Fälle zeigt nicht nur die zunehmende Bedeutung in Deutschland, sondern auch die Zunahme autoch-thoner Fälle – im Vergleich zu den Erkrankungszahlen vergangener Jahre, die überwiegend reiseassoziiert waren.
Im Rahmen eines Forschungsvorhabens[1] mit der Tierärztlichen Hochschule Hannover und dem Bundesinstitut für Risikobewertung wurden nach Etablierung sensitiver HEV-Nachweisverfahren aus Proben von Tieren und aus Lebensmitteln die Wildtierpopulationen auf das Vorkommen von HEV untersucht. Da HEV-Feldstämme in der Zellkultur nicht anzüchtbar sind, ist der Nachweis mittels -RT-PCR derzeit der Goldstandard in der Labordiagnostik. Mit Hilfe der deutlich verbesserten Nachweismethoden wurden zum einen bis zu 25 % des Schwarzwildes Virus-positiv getestet, das Virus konnte auch erstmals in Deutschland bei Reh- und Rotwild nachgewiesen werden. Darüber hinaus wurden mittels optimierter Methoden auch Roh- und Leberwürste aus dem Handel untersucht, wobei etwa 20 % der Würste HEV-positiv waren [11].
Diskussion
Zoonosen- und Tierseuchenerreger sind als Infektionsursachen weltweit von sehr großer Bedeutung, wobei deren Vorkommen stark von den lokalen
Die Durchführung von Monitoringuntersuchungen auf hochkontagiöse Tierseuchen im Zuständigkeitsbereich der Bundeswehr sind zudem ein wesentliches Element bei der Wahrnehmung hoheitlicher Aufgaben. Die enge Kooperation mit den im zivilen Bereich zuständigen Stellen ermöglicht hierbei nicht nur den intensiven methodischen Austausch, sondern bildet auch eine wichtige Grundlage für ein gemeinsames abgestimmtes Vorgehen in der Überwachung der Tiergesundheit.
Die Einbeziehung potenzieller Wildtierreservoire ermöglicht auch außerhalb von Ausbrüchen die valide Erfassung der An- oder Abwesenheit von Infektionserregern. Tendenzen in den Nachweisraten über längere Beobachtungszeiträume, wie am Beispiel der SBV-Serologie gezeigt, können hierbei wichtige Grundlage für die Risikobewertung von Tierseuchen und Zoonosen sein.
Die gleichzeitige Etablierung einfacher robuster Nachweissysteme im Zuge dieser Monitoringuntersuchungen stellt mit Blick auf die einsatzorientierte Diagnostik einen gewünschten positiven Effekt dar. Die Bluttupfer können im Rahmen der Reviergänge, aber auch im Einsatz, problemlos mitgeführt und direkt zur Untersuchungseinrichtung transportiert werden. Mit diesem Vorgehen wurde nicht nur eine wesentliche diagnostische -Lücke im Rahmen des Schweinepestmonitorings geschlossen, sondern auch eine einfache und sehr robuste Probenahmetechnik etabliert. Der Versand von Organen oder ganzen Tierkörpern entfällt. Bisher wurden zunächst zwei Infektionserreger (Schweinepest und Hepatitis E) einbezogen, die Erweiterung auf andere Erreger kann jederzeit erfolgen. Wesentlich ist allerdings, dass der Probenehmer bei einem erweiterten Erregerspektrum auch über die notwendige fachliche Kompetenz verfügen muss, um für die in Frage kommenden Erreger auch die Beprobung einzelner Organe, Körperflüssigkeiten oder Ausscheidungen gezielt durchführen zu können. Andernfalls sind durch eine fehlerhafte Probenahme falsch negative Ergebnisse nicht zu vermeiden. Diese fachliche Kompetenz des Probenehmers vorausgesetzt, eignet sich das System somit auch hervorragend für den Einsatz im Rahmen von Ausbruchsuntersuchungen. Da nur ein Teil des jeweiligen Tupfers für das erste Screening verwendet wird, können jederzeit weiterführende Untersuchungen in spezialisierten Laboren durchgeführt werden. Zudem ist nicht nur die molekularbiologische Untersuchung, sondern auch der serologische Nachweis von Antikörpern möglich [2]. Die Kombination dieser einfachen Probenahmetechnik mit bereits für den Einsatz etablierten PCR-Systemen [12] ermöglicht somit auch in Einsatz- oder Krisengebieten die verzugsfreie Etablierung molekularer und serologischer Nachweissysteme.
In der Wildtierpopulation vorkommende Zoonoseerreger stellen nicht nur bei dem häufig intensiven Kontakt der Soldaten mit der Umwelt, sondern auch bei Übertragung durch Arthropoden oder Lebensmittel ein unmittelbares Infektionsrisiko dar. Ob die regional sehr unterschiedlichen HEV-Nachweise in der Schwarzwildpopulation auch zu regional erhöhten HEV-Infektionen beim Menschen führen oder der derzeit eher angenommene lebensmittel-bedingte Übertragungsweg, müssen zukünftige Studien zeigen.
Zusammenfassend kann festgestellt werden, dass sich durch die Erweiterung bestehender Monitoringuntersuchungen vielfältige Synergie-Effekte erzielen lassen, um gleichzeitig robuste und feldtaugliche Nachweismethoden zu etablieren. Durch die labordiagnostisch gesicherte Erfassung des Erregervorkommens können unmittelbar vorkommende Risiken verifiziert werden und darauf aufbauend gezielte Präventionsmaßnahmen empfohlen werden.
Kernaussagen/Fazit
- Zoonosen und Tierseuchenerreger sind sowohl in Deutschland als auch in Einsatzgebieten der Bundeswehr von hoher wirtschaftlicher aber auch gesundheitlicher Bedeutung und können die Auftragserfüllung mitunter erheblich beeinträchtigen.
- Durch das regional sehr unterschiedliche Vorkommen ist ein auf das Einsatzgebiet abgestimmtes Monitoring auf Grundlage validierter und robuster Diagnostik eine wesentliche Voraussetzung für die gezielte Risikobewertung und daraus abgeleiteten Präventionsempfehlungen.
- Die seit Jahren am ZInstSanBw Kiel durchgeführten Monitoringuntersuchungen ermöglichen neben der Erreger-spezifischen Risikobewertung für die untersuchten Übungsplätze in Deutschland auch die Etablierung und Validierung von im Einsatz durchführbaren einfachen und robusten Methoden.
- Aufbauend auf den vorliegenden epidemiologischen Informationen aus den Einsatzgebieten kann diese Diagnostik ggf. auch kurzfristig an das Erregervorkommen angepasst werden und ermöglicht damit valide Daten als wesentlicher Teil der „Force Health Protection“.
Literatur
- Balenghien T, Cardinale E, Chevalier V et al.: Towards a better understanding of Rift Valley fever epidemiology in the south-west of the Indian Ocean. Vet Res 2013; 44 - 78.
- Blome S, Goller KV, Petrov A et al., Alternative sampling strategies for passive classical and African swine fever surveillance in wild boar--extension towards African swine fever virus antibody detection. Vet Microbiol 2014; 174: 607 - 608.
- Domenech, J, Lubroth J, Eddi C, Martin V, Roger F: Regional and international approaches on prevention and control of animal transboundary and emerging diseases. Ann N Y Acad Sci 2006; 1081: 90 - 107.
- Friedrich-Loeffler-Institut (2014a) Kapitel 2: Afrikanische Schweinepest. Amtliche Sammlung von Verfahren zur Probenahme und Untersuchung von Untersuchungsmaterial tierischen Ursprungs im Hinblick auf anzeigepflichtige Tierseuchen. https://openagrar.bmel-forschung.de/receive/openagrar_mods_-- 00005162.
- Friedrich-Loeffler-Institut (2014b) Kapitel 29: Klassische Schweinepest. Amtliche Sammlung von Verfahren zur Probenahme und Untersuchung von Untersuchungsmaterial tierischen Ursprungs im Hinblick auf anzeigepflichtige Tierseuchen. https://openagrar.bmel-forschung.de/receive/openagrar_mods_ 00005672.
- Hoffmann B, Scheuch M, Höper D et al.: Novel orthobunyavirus in Cattle, Europe, 2011. Emerg Infect Dis 2012; 18: 469 - 472.
- Hoffmann B, Schulz C, Beer M: First detection of Schmallenberg virus RNA in bovine semen, Germany 2012. Vet Microbiol 2013. 167:289-95.
- Jones KE, Patel NG, Levy MY et et al.: Global trends in emerging infectious diseases. Nature 2008; 451: 990 - 993.
- Mirazo S, Ramos N, Mainardi V, Gerona S, Arbiza J: Transmission, diagnosis, and management of hepatitis E: an update. Hepat Med. 2014; 6: 45 - 59.
- Petrov A, Schotte U, Pietschmann J et al.: ,Alternative sampling strategies for passive classical and African swine fever surveillance in wild boar. Vet Microbiol 2014; 173: 360 - 365.
- Szabo K, Trojnar E, Anheyer-Behmenburg H et al.: Detection of hepatitis E virus RNA in raw sausages and liver sausages from retail in Germany using an optimized method. Int J Food Microbiol 2015; 215: 149 - 156.
- Tandler H, Schotte U, Binder A: Mikrobiologische PCR-Nachweisverfahren im Einsatz. Wehrmed Mschr 2012; 56: 194 - 197.
- Weaver SC, Reisen WK: Present and future arboviral threats. Antiviral Res 2010 85: 328 - 345.
- Wernike K, Hoffmann B, Conraths FJ, Beer M: Schmallenberg Virus Recurrence, Germany, 2014. Emerg Infect Dis 2015; 21: 1202 - 1204.
- Woolhouse ME, Gowtage-Sequeria S: Host range and emerging and reemerging pathogens. Emerg Infect Dis 2005; 11: 1842 - 1847.
Bildquellen:
Abb. 1 und 2: ZInstSanBw Kiel, Abt. II
Abb. 3: Institut für Virusdiagnostik, Friedrich-Loeffler-Institut, Greifswald Insel Riems
Für die Verfasser:
Oberfeldveterinär Dr. Ulrich Schotte
Zentrales Institut des Sanitätsdienstes der Bundeswehr Kiel
Abteilung II -Veterinärmedizin-
Kopperpahler Allee 120
24119 Kronshagen
E-Mail: UlrichSchotte@bundeswehr.org
[1]
Bearbeitung im Rahmen des Forschungsvorhabens für den Sanitätsdienst der Bundeswehr (Projektnummer E-UR2W-CF507-CF553 Entwicklung von sensitiven Nachweisverfahren für Hepatitis E-Viren in Lebensmitteln, Trinkwasser und Umgebungsproben. Stiftung Tierärztliche Hochschule Hannover, Institut für Lebensmittelqualität und -sicherheit, ZlnstSanBw Kiel, Abteilung II Veterinärmedizin)
Datum: 29.08.2016
Wehrmedizinische Monatsschrift 2016/6