ANTIBIOTIC STEWARDSHIP – EIN STRATEGISCHES KONZEPT IM ZEITALTER ZUNEHMENDER BAKTERIELLER MULTIRESISTENZ
Antibiotic stewardship – A strategic concept in the age of increasing bacterial multi-drug resistance
Aus der Abteilung I Medizin (Abteilungsleiter: Flottenarzt Dr. Martin Müller) des Zentralen Instituts des Sanitätsdienstes der Bundeswehr Kiel (Leiter: Oberstveterinär Dr. Hans Herbert Pott), Außenstelle Berlin
Martin Müller, Werner Wenzel und Renate Gatzer
WMM, 58. Jahrgang (Ausgabe 3/2014; S. 94-99)
Zusammenfassung
Hintergrund: Seit Mitte der neunziger Jahre des vorigen Jahrhunderts sehen sich die Gesundheitssysteme vieler Staaten mit der zunehmenden Verbreitung multiresistenter bakterieller Krankheitserreger (MRE) konfrontiert. Auch in den Krankenhäusern und Einsatzlazaretten der Bundeswehr nimmt das Management von MRE-Infektionen breiten Raum ein.
Methoden: Im Mittelpunkt einer als „Antibiotic Stewardship“ (ABS) bezeichneten Strategie steht die Qualitätsverbesserung beim therapeutischen Einsatz von Antiinfektiva. Wesentliche ABS-Instrumente werden am BwKrhs Berlin bereits angewendet.
Ergebnisse: Die am BwKrhs Berlin durchgeführten ABS-Maßnahmen führten zu einer intensiven interdisziplinären Zusammenarbeit auf dem Gebiet der antimikrobiellen Therapie und einer Optimierung der Verordnungspraxis.
Perspektiven: Die Umgliederung des Sanitätsdienstes bietet die Möglichkeit, an allen Bundeswehrkrankenhäusern Antibiotic Stewardship strukturell zu verankern.
Schlagworte: Antibiotic Stewardship, bakterielle Multiresistenz, Antibiotika-Leitlinie, Erreger-Resistenz-Statistik, Interdisziplinarität
Summary
Background: Since the 1990s many national health systems are confronted with the increasing spread of multi-drug resistant bacteria. In Bundeswehr hospitals and deployed medical treatment facilities infections with these germs are a well-known challenge.
Methods: The main objective of the antibiotic stewardship (ABS) strategy is to improve the quality of antimicrobial treatment. Some essential ABS tools are already in use at Bundeswehr hospital in Berlin.
Results: The ABS-procedures applied led to an intense interdisciplinary cooperation between clinicians, clinical pharmacists, hygiene specialists and microbiologists on the field of antimicrobial therapy.
Perspectives: The reorganization of the Bundeswehr Medical Service offers the opportunity to install ABS structures wherever needed.
Keywords: antibiotic stewardship, bacterial multi-drug resistance, antibiotic therapy guideline, pathogen-resistance-data, interdisciplinarity
Bakterielle Multiresistenz bei grampositiven Erregern
Die Fähigkeit von Mikroorganismen, Resistenzmechanismen gegenüber antimikrobiell wirksamen Arzneimitteln zu entwickeln, stellt seit jeher eine Herausforderung in der medikamentösen Behandlung von Infektionen dar. Schon bald nach der Entdeckung und Einführung des Penicillins als Therapeutikum 1928 bzw. 1941 wurden erste Penicillin-resistente Bakterienisolate nachgewiesen. Nach Einführung des Methicillins als Prototyp der sogenannten „Penicillinase-festen“ Isooxazolylpenicilline 1959 dauerte es nur zwei Jahre, bis Methicillin-resistente Staphylococcus-aureus (MRSA)-Stämme angezüchtet wurden, die sich nicht nur gegenüber allen Beta-Lactam-Antibiotika unempfindlich zeigten, sondern in zunehmendem Umfang auch Resistenzen gegenüber anderen Substanzen, wie Makroliden, Fluorchinolonen und Lincosamiden entwickelten.
Ab Mitte der neunziger Jahre des vergangenen Jahrhunderts nahm die MRSA-Prävalenz in zahlreichen Ländern, auch in Deutschland, deutlich zu und wurde zu einer erheblichen Belastung der Gesundheitssysteme. Die in Dreijahreszeiträumen veröffentlichten Daten der Paul-Ehrlich-Gesellschaft für Chemotherapie (PEG) zeigen einen Anstieg der MRSA-Prävalenz von 0,4 % 1978 über 15,2 % im Jahr 1998 auf 20,3 % im Jahr 2007 [1-3]. Aktuelle Daten weisen neuerdings darauf hin, dass die erheblichen Anstrengungen, die in Deutschland in Anlehnung an die Maßnahmen anderer europäischer Staaten unternommen wurden, und der Einsatz neuer oder bisher für andere Indikationen verwendeter Substanzen wie Glykopeptide, Linezolid, Daptomycin und Tigecyclin Erfolg haben könnten; der ungünstige Trend in der MRSA-Ausbreitung in Deutschland scheint gestoppt.
Andere grampositive Krankheitserreger mit Multiresistenzproblematik, beispielsweise Vancomycin resistente Enterococcus-faecium-Stämme, sind zwar in Deutschland präsent, zeigen aber im Vergleich zu MRSA mit 12,6 % eine deutlich niedrigere, regional unterschiedliche Prävalenz [3, 4].
Bakterielle Multiresistenz bei gramnegativen Erregern
Im Gegensatz zur Situation bei den grampositiven Krankheitserregern ist die Resistenzentwicklung bei den gramnegativen Bakterien Besorgnis erregend.
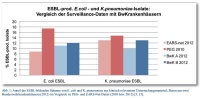
Die Daten nationaler und internationaler Antibiotikaresistenz-Surveillancesysteme zeigen eine seit mehreren Jahren anhaltende Tendenz zur Ausbreitung multiresistenter gramnegativer Bakterienstämme. Vor allem die aus klinischem Untersuchungsmaterial häufig nachzuweisenden Spezies Escherichia coli und Klebsiella pneumoniae verfügen immer häufiger über die Fähigkeit zur Bildung von Breitspektrum-Beta-Lactamasen (ESBL), die Penicilline und Cephalosporine hydrolysieren. Unter Zugrundelegung der Daten des Europäischen Zentrums für Krankheitsprävention und -kontrolle ECDC (EARS-Net) ist der Anteil der ESBL-produzierenden E.-coli-Stämme in Deutschland in Blut und Liquor von 0 % im Jahr 1999 auf 8,8 % im Jahr 2011 angestiegen, die PEG-Resistenzstudie 2010 gibt mit 17,4 % in klinisch relevanten Untersuchungsmaterialien noch deutlich höhere Werte an [3, 5]. Der Anteil der ESBL-bildenden K.-pneumoniae-Stämme erhöhte sich hierzulande nach EARS-Net im Zeitraum 2005 bis 2011 von 6,7 % auf 12,5 % (PEG 2010: 14,7 %). Diese alarmierende Situation ist in anderen europäischen Ländern wie beispielsweise Griechenland wesentlich dramatischer (Prävalenz ESBL-positiver K.-pneumoniae-Stämme: über 70 %) [5].
In vielen Fällen ist die Beta-Lactam-Resistenz mit anderen Resistenzeigenschaften vergesellschaftet, unter denen die Unempfindlichkeit gegenüber Fluorchinolonen (Leitsubstanz Ciprofloxacin) von besonderer Bedeutung ist. Die therapeutischen Möglichkeiten bei schweren Infektionen durch diese gemäß aktueller Klassifikation als „3MRGN“ bezeichneten Mikroorganismen (multiresistente gramnegative Bakterien, resistent gegenüber den drei bakterizid wirkenden Antibiotikagruppen Acylureidopenicilline, Gruppe 3-Cephalosporine, Fluorchinolone) sind deutlich eingeschränkt [6]. Als wirksamste Medikation gilt hier die Anwendung von Carbapenemen, also der vierten bakteriziden Substanzgruppe mit breitem Wirkungsspektrum.
Die Verordnung von Carbapenemen ist in epidemiologischer und therapeutischer Hinsicht allerdings nicht unproblematisch, da auch hier eine ungünstige Resistenzentwicklung zu verzeichnen ist [7]. In Deutschland mit etwa 2 % Carbapenem-resistenten K.-pneumoniae-Isolaten noch eine Rarität, ist die Situation in anderen Regionen wie etwa Griechenland mit einer Prävalenz von mehr als 60 % dramatisch [5]. Da Carbapenem-Resistenz bei Enterobakterien überwiegend als Parallelresistenz im Sinne einer „4MRGN“-Situation auftritt, stehen für eine antimikrobielle Therapie meist nur die Reservesubstanzen Tigecyclin und Colistin, ggf. in Kombination mit Aminoglykosiden oder Fosfomycin, zur Verfügung. Als mögliche Behandlungsstrategie wird auch die sogenannte „Doppel-Carbapenem-Therapie“ diskutiert [8]. Eine 4MRGN-Resistenz findet sich im Übrigen gelegentlich auch bei den im Krankenhausumfeld auftretenden „Problemkeimen“ Pseudomonas aeruginosa und Acinetobacter baumannii. Insgesamt ist somit das Portfolio zur Behandlung lebensbedrohlicher Infektionen mit multiresistenten gramnegativen Krankheitserregern – im Gegensatz zur Situation bei den grampositiven Bakterien – sehr begrenzt. Auch bei Einsatz der genannten Reservemedikamente ist jederzeit mit einer nachlassenden Wirksamkeit dieser Substanzen zu rechnen, so dass die in der Fachliteratur publizierte Einschätzung, man nähere sich der „post-antibiotischen“ Ära, durchaus berechtigt erscheint [9]. Pharmazeutische Neuentwicklungen sind für die nächsten Jahre nicht zu erwarten. Allenfalls die Einführung des Lactamase-Inhibitors Avibactam verspricht einen gewissen Fortschritt in der Behandlung von MRGN-Infektionen
Die Ursachen für die dramatische Ausbreitung multiresistenter bakterieller Krankheitserreger (MRE) sind vielfältig. Die Antibiotikaanwendung bei Tieren und Menschen fördert die Selektion resistenter mikrobieller Mutanten. Durch horizontalen Transfer von mobilen Resistenzgenen kommt es auch zur Übertragung auf weitere Bakterienspezies. Die klonale Ausbreitung ist in der Regel ein Hygieneproblem und kann bei Hospitalkeimen zu den gefürchteten Ausbrüchen führen [10 - 14].
Bakterielle Multiresistenz im militärmedizinischen Umfeld
In den Bundeswehrkrankenhäusern als Einrichtungen, die in die zivile Gesundheitsversorgung eingebunden sind, ist der Umgang mit multiresistenten Krankheitserregern nichts Ungewöhnliches. Insbesondere in Ballungsgebieten wie Berlin stellt die Zirkulation von MRE zwischen dem ambulanten Pflegesektor und dem stationären Behandlungsbereich eine erhebliche Herausforderung dar. Ausbrüche von Infektionen mit gramnegativen Bakterien führen, unabhängig vom jeweiligen Resistenzprofil, zu einer erheblichen Ressourcenbindung und sie können, wie die Ereignisse in einigen Großkrankenhäusern in den vergangenen Jahren zeigten, auch mit einem gewissen Reputationsverlust verbunden sein. Nicht zuletzt wegen der engen Vernetzung mit dem zivilen Gesundheitssystem sind Ausbrüche grundsätzlich auch in den fünf Bundeswehrkrankenhäusern vorstellbar.
Die von der Abteilung I des Zentralen Instituts des Sanitätsdienstes der Bundeswehr Kiel, Außenstelle Berlin (ZInstSanBw Kiel, ASt Berlin) als zuständigem mikrobiologischen Labor für die Bundeswehrkrankenhäuser (BwKrhs) Berlin und Hamburg erhobenen epidemiologischen Daten belegen, dass der Anteil ESBL-produzierender Stämme bei den wichtigsten gramnegativen Infektionserregern E. coli und K. pneumoniae im Jahr 2012 mit 10 bis 13 % in etwa den für Deutschland gemeldeten Daten von EARS-Net (9 bis 13 %) entspricht [5].
Das spezifische militärmedizinische Umfeld bietet allerdings zusätzliche Risiken: Die Behandlung libyscher und syrischer Bürgerkriegsopfer in verschiedenen Bundeswehrkrankenhäusern 2011 und 2013 zeigte, dass die unfallchirurgische Versorgung dieser Patienten in nicht unwesentlichem Umfang durch MRE kompliziert werden kann. Ein Erfahrungsbericht der Abteilung Unfallchirurgie/Orthopädie des BwKrhs Hamburg, der kürzlich unter Verwendung mikrobiologischer Daten des ZInstSanBw Kiel, ASt Berlin, veröffentlicht wurde, stellt anschaulich dar, mit welch erheblichem Aufwand eine angemessene Behandlung und Pflege von polymikrobiell infizierten und kolonisierten Patienten betrieben werden muss, um eine Ausbreitung dieser Problemkeime auf andere Patienten und das Personal zu verhindern [15]. Aus den epidemiologischen Auswertungen der im Einsatzlazarett Mazar-e Sharif/Afghanistan erhobenen mikrobiologischen Befunde der Jahre 2011 und 2012 ist erkennbar, dass auch in den Einsatzgebieten der Bundeswehr deutsches Sanitätspersonal mit Patienten konfrontiert wird, die mit MRE kolonisiert oder infiziert sind [16]. Neben der Notwendigkeit, sowohl im Einsatz als auch in der Inlandsversorgung ein konsequentes Hygienemanagement zu betreiben, ist es in Anbetracht der dargestellten Situation dringend geboten, die verfügbaren antimikrobiellen Substanzen verantwortungsvoll einzusetzen, um dem erkrankten Patienten die bestmögliche Therapie zukommen zu lassen und eine weitere Resistenzentwicklung der Krankheitserreger nach Möglichkeit zu vermeiden.
Diesen Ansatz verfolgt „Antibiotic Stewardship“.
Grundsätze von Antibiotic Stewardship
Antibiotic Stewardship (ABS)-Programme wenden den englischen Begriff des verantwortungsvollen Verwaltens (altenglisch: stigweard = Hallenverwalter, Haushofmeister) auf den Einsatz antimikrobieller Substanzen in Therapie und Prophylaxe von bakteriellen Infektionskrankheiten beim Menschen an, im Sinne einer verantwortungsbewussten „rationalen“, standardisierten und evidenzbasierten Antibiotika-Verordnung und –Anwendung unter Berücksichtigung von Dosierung, Therapiedauer und Therapieform [17 - 19]. Einer Definition von McDougall und Polk folgend dienen ABS-Programme der Optimierung des Antibiotikagebrauchs mit dem Ziel, das Behandlungsergebnis zu verbessern, die Kosteneffizienz zu steigern und ungünstige Behandlungsfolgen einschließlich Resistenzentwicklung zu reduzieren [17].
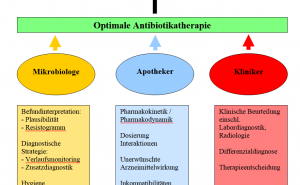
Typische Elemente eines ABS-Programms sind in Tabelle 1 dargestellt. Sie umfassen bestimmte „Grundlagendokumente“ wie die Antibiotika-Hausliste als Zusammenstellung der in der Einrichtung grundsätzlich verfügbaren Antiinfektiva und eine Antibiotika-Leitlinie, die als hausinterner Therapiestandard angesehen werden kann und in enger Abstimmung mit den klinischen Anwendern erstellt werden sollte. Für die Abfassung derartiger Leitlinien ist die Kenntnis von lokaler Erregerhäufigkeit und Resistenzsituation erforderlich, so dass dem zuständigen mikrobiologischen Labor als Datenquelle und Surveillance-Instanz eine wesentliche Bedeutung zukommt. Die klinische Pharmazie leistet unter anderem mit dem Antibiotika-Verbrauchsmonitoring einen wichtigen Beitrag. Schließlich ist auch die Implementierung einer institutionalisierten Struktur, z.B. einer „Antibiotika-Kommission“ oder eines „ABS-Teams“, erforderlich, die, ausgestattet mit einem Mandat der Krankenhausleitung, die einzelnen ABS-Maßnahmen vorbereitet, einer Entscheidung durch die Krankenhausleitung zuführt, die Einhaltung überwacht und als Beratungsinstanz zur Verfügung steht [18, 19].
Angesichts der zunehmenden bakteriellen Multiresistenz-Problematik hat die Weltgesundheitsorganisation (WHO) 1998 die Erarbeitung nationaler Leitlinien und der Rat der Europäischen Union 2001 in der Deklaration von Visby den sparsamen Umgang mit antimikrobiellen Agenzien empfohlen. Daraufhin wurde auf nationaler Ebene in Deutschland mit der Änderung des § 23 Infektionsschutzgesetz (IfSG) zum 28.07.2011 eine rechtliche Grundlage geschaffen, die der um sich greifenden Resistenzentwicklung klinisch relevanter Mikroorganismen in Einrichtungen der stationären Krankenversorgung und für ambulante Operationen Rechnung trägt [20]. Die bisherige Erfassungspflicht für nosokomiale Infektionen und Erreger mit besonderen Resistenzen nach § 23 IfSG (alt) wurde um verschiedene zusätzliche Verpflichtungen erweitert, beispielsweise um die Erfassung des Antibiotikaverbrauchs. Diese ist, ebenso wie die Dokumentation der mikrobiologischen Resistenzdaten, regelmäßig zu bewerten mit dem Ziel, aus den Bewertungen gegebenenfalls Konsequenzen für das Antibiotika-Management des Hauses zu ziehen. Außerdem resultiert eine Informationspflicht gegenüber dem Personal der Einrichtung. Schließlich wurde mit Veröffentlichung der S3-Leitlinie "Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaus" im Dezember 2013 eine Anleitung geschaffen, die es jedem Krankenhaus erleichtert, ABS-Strukturen einzurichten [21].
Ein wesentliches Element von Antibiotic Stewardship ist die Vermittlung fachlicher Expertise in möglichst allen Einrichtungen der Gesundheitsversorgung. Unter der Schirmherrschaft der Deutschen Gesellschaft für Infektiologie (DGI) in Kooperation mit dem Bundesverband Deutscher Krankenhausapotheker (ADKA) und der PEG, unterstützt vom Bundesministerium für Gesundheit (BMG), wurde 2009 von einem Freiburger Infektiologen-Team unter W. V. Kern und K. de With (IF) die „ABS-Fortbildungsinitiative“ eingeführt. Diese hatte es sich zum Ziel gesetzt, bis Ende 2013 in einem drei- bis vierwöchigen modular aufgebauten Seminar mit Praktikum 200 Ärzte und Apotheker zu schulen und zu zertifizierten „ABS-Experten“ zu qualifizieren. Diese Zahl wurde mittlerweile erheblich überschritten.
Antibiotic Stewardship am BwKrhs Berlin
An den am Standort Berlin stationierten Einrichtungen des Zentralen Sanitätsdienstes – BwKrhs Berlin und ZInstSanBw Kiel, ASt Berlin - hat sich bereits vor einigen Jahren eine interdisziplinäre Arbeitsgruppe aus Klinikern der Intensivstationen, Klinischen Pharmazeuten und Vertretern des mikrobiologischen Labors zusammengefunden mit der Absicht, das Antibiotika-Management zu optimieren. So wurde im Jahr 2007 eine regelmäßige interdisziplinäre Antibiotikatherapiekonferenz auf den Intensivpflegestationen des Krankenhauses eingerichtet, die neben der täglichen telefonischen Beratung einmal wöchentlich klinische, mikrobiologische und pharmakologische Aspekte der stationären Patientenbehandlung erörtert und Therapiestrategien festlegt. Eine ähnliche Vorgehensweise wurde vor einem Jahr in der Sektion Abdominalchirurgie des Krankenhauses etabliert, die mittlerweile auch auf den gefäßchirurgischen Behandlungsbereich ausgeweitet werden konnte. Erreger-Resistenz-Statistiken werden seit zwei Jahren regelmäßig erstellt und im Rahmen einer jährlichen Fortbildungsveranstaltung präsentiert. Auf der Grundlage nationaler und internationaler Leitlinien wurde unter Berücksichtigung der lokalen Resistenzsituation und unter Einbeziehung aller stationären Behandlungsbereiche eine hausinterne Antibiotika-Leitlinie entwickelt, die nunmehr Grundlage der kalkulierten Initialtherapie schwerer Infektionen ist. Dieses Dokument liegt in verschiedenen Druckversionen, u. a. in einem „Kitteltaschenformat“, für die allgemeine Nutzung vor und findet breite Anwendung.
Der Antibiotikaverbrauch wird im Sinne § 23 IfSG durch die Klinische Pharmazie des BwKrhs Berlin erfasst und überwacht. Die Pharmazeuten führen zudem eine intensive Beratungstätigkeit auf den Stationen des Hauses durch, bei der insbesondere pharmakokinetische und pharmakodynamische Aspekte von Arzneimitteln erörtert werden. Im mikrobiologischen Labor erhobene hygienerelevante Befunde werden unverzüglich dem Beratenden Krankenhaushygieniker mitgeteilt; mögliche Behandlungsstrategien und präventivmedizinische Konsequenzen werden im interdisziplinären Gespräch festgelegt.
In Anlehnung an die Empfehlungen des Rates der Europäischen Union, die IDSA-Leitlinien und weitere Expertenmeinungen bemühen sich die beteiligten Fachdisziplinen am Standort Berlin derzeit, den ABS-Gedanken in einer institutionalisierten Struktur weiter zu entwickeln. Die Voraussetzungen hierfür sind vielversprechend, da bereits mehrere Sanitätsoffiziere Arzt und Apotheker entweder den Expertenstatus des ABS-Fortbildungsprogamms der Infektiologie Freiburg erreicht oder einen entsprechenden Kurs der Universitätsklinik Münster absolviert haben, der im September / Oktober 2013 auf Initiative der Abteilung V des damaligen Sanitätsamtes der Bundeswehr erstmalig angeboten wurde.
Dass der beschrittene Weg zu einem Antibiotic Stewardship Früchte trägt, ist aus Sicht der Autoren unbestreitbar. Neben dem Ausbau einer belastbaren Verständnis- und Vertrauensbasis zwischen den beteiligten Klinikern und Nicht-Klinikern konnte durch die aktive Antibiotika-Beratung eine deutliche verbesserte Leitlinienadhärenz bei der Antibiotikatherapie erreicht werden, die sich u. a. im reduzierten Einsatz von Reservesubstanzen bemerkbar macht.
Perspektiven in einer zukünftigen Struktur
Nach Auffassung der Autoren bietet die anstehende Neuausrichtung der Bundeswehr eine hervorragende Gelegenheit, den aus der dargestellten ungünstigen Resistenzentwicklung bei relevanten Infektionserregern entstehenden Handlungsbedarf in der Struktur der Krankenhäuser zu berücksichtigen. Neben der Ausplanung von funktionsfähigen Teileinheiten „Krankenhaushygiene“ sollten die mikrobiologischen Fachlaboratorien an allen Bundeswehrkrankenhäusern adäquat und durchhaltefähig aufgestellt werden, um den diagnostischen und konsiliarischen Bedarf der Behandlungseinrichtungen im Grundbetrieb Inland wie auch im Auslandseinsatz vor Ort adäquat zu befriedigen. An allen Bundeswehrkrankenhäusern wären Antibiotika-Kommissionen oder ABS-Teams einzurichten, die sich für eine bedarfsgerechte, verantwortungsbewusste Antibiotikatherapie einsetzen und diese auch überwachen. Ein wichtiger Schritt zur Implementierung von ABS-Strukturen in der Bundeswehr war die Einrichtung eines modular aufgebauten Fortbildungsseminars am Institut für Mikrobiologie der Universitätsklinik Münster, das im Herbst 2013 erstmalig abgehalten wurde. Dieser Kurs könnte nun den Grundstein für die Einrichtung eines Bundeswehr-internen ABS-Netzwerks bilden.
Vor dem Hintergrund der ungünstigen epidemiologischen Gesamtsituation und der fehlenden Innovation auf dem Antibiotikamarkt ist der sparsame, wohl überlegte Antibiotikaeinsatz im Rahmen eines institutionalisierten Antibiotic Stewardship-Programms ein wichtiges Instrument, um der erschreckenden Vorstellung eines „postantibiotischen Zeitalters“ entgegen zu wirken.
Literatur
- Kresken M, Hafner D, Schmitz FJ, Wichelhaus TA für die Studiengruppe: PEG-Resistenzstudie 2001. Resistenzsituation bei klinisch wichtigen Infektionserregern gegenüber Antibiotika in Deutschland und im mitteleuropäischen Raum. Bericht über die Ergebnisse einer multizentrischen Studie der Arbeitsgemeinschaft Empfindlichkeitsprüfungen & Resistenz der Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. aus dem Jahre 2001. Antiinfectives Intelligence, Bonn, 2003.
- Kresken M, Hafner D, Schmitz FJ, Wichelhaus TA für die Studiengruppe: PEG-Resistenzstudie 2007. Resistenzsituation bei klinisch wichtigen Infektionserregern gegenüber Antibiotika in Deutschland und im mitteleuropäischen Raum. Bericht über die Ergebnisse einer multizentrischen Studie der Arbeitsgemeinschaft Empfindlichkeitsprüfungen & Resistenz der Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. aus dem Jahre 2007. Antiinfectives Intelligence, Rheinbach, 2009.
- Kresken M, Hafner D, Körber-Irrgang B für die Studiengruppe: PEG-Resistenzstudie 2010, Teilprojekt H. Epidemiologie und Resistenzsituation bei klinisch wichtigen Infektionserregern aus dem Hospitalbereich gegenüber Antibiotika. Bericht über die Ergebnisse einer multizentrischen Studie der Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. aus dem Jahre 2010. Antiinfectives Intelligence, Bonn, 2013.
- Robert-Koch-Institut: Vancomycin-resistente Enterokokken (VRE): Aktuelle Daten und Trends zur Resistenzentwicklung aus dem NRZ für Staphylokokken und Enterokokken, 2011-2012. Epid Bull 2013; 33: 303-9:
- European Centre for Disease Prevention and Control: Antimicrobial resistance interactive database EARS-Net; Datenabfrage vom 15.10.2013. www.ecdc.europa.eu.
- Kommission für Krankenhaushygiene und Infektionsprävention am Robert-Koch-Institut: Definition der Multiresistenz gegenüber Antibiotika bei gramnegativen Stäbchen im Hinblick auf Maßnahmen zur Vermeidung der Weiterverbreitung. Epid Bull 2011; 36: 337-9.
- Castanheira M, Mendes RE, Woosley LN, Jones RN: Trends in carbapenemase-producing Escherichia coli and Klebsiella spp. from Europe and the Americas: report from the SENTRY antimicrobial surveillance programme (2007-09). J Antimicrob Chemother 2011; 66 (6): 1409-11.
- Bulik CC, Nicolau DP: Double-carbapenem therapy for carbapenemase-producing Klebsiella pneumoniae. Antimicrob Agents Chemother 2011; 55: 3002-4.
- Wise R: Antimicrobial resistance: paradox actions and economics. J Antimicrob Chemother 2006; 57: 1189-96.
- Witte W, Mielke M: ß-Lactamasen mit breitem Wirkungssspektrum. Bundesgesundheitsbl 2003; 46: 881-90.
- Paterson DL: „Collateral Damage“from Cephalosporin or Quinolone Antibiotic Therapy. Clin Infect Dis 2004; 38 (Suppl 4): S341-5.
- Pfeifer Y, Eller C: Aktuelle Daten und Trends zur ß-Lactam-Resistenz bei gramnegativen Infektionserregern. Bundesgesundheitsbl 2012; 55: 1405-9.
- Geffers C, Gastmeier P: Nosokomiale Infektionen und multiresistente Erreger in Deutschland. Epidemiologische Daten aus dem Krankenhaus-Infektions-Surveillance-System. Dt Ärztebl 2011; 108 (6): 87-93.
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF: Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Dt Ärztebl 2012; 109 (3): 39-45.
- Klein B, Becker D, Urbach M, Mügge G: Versorgung libyscher Kriegsverletzter.am Bundeswehrkrankenhaus Hamburg unter spezieller Berücksichtigung der Hygienemaßnahmen. Wehrmed Wehrpharm 2013; 1: 52-4.
- Helm F: Einsatzsurveillance. ISAF und die Maxime des Inspekteurs. Wehrmed Wehrpharm 2013; 1: 40-5.
- McDougall C, Polk ER: Antimicrobial Stewardship Programs in Health Care Systems. Clin Microbial Rev 2005; 18: 638-656.
- Dellit TH, Owens RC, McGowan JE Jr, Gerding DN, Weinstein RA, Burke JP, Hershing WC, Paterson DL, Fishman NO, Carpenter CF, Brennan PJ, Billeter M, Hooton TM: Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship. Clin Infect Dis 2007; 44 (2): 159-77.
- Allerberger F, Lechner A, Wechsler-Fördös A, Gareis R on behalf of ABS International: Optimization of Antibiotic Use in Hospitals – Antimicrobial Stewardship and the EU Project ABS International. Chemotherapy 2008; 54: 260-7.
- Council of the European Union: Council Recommendation of 15 November 2001 on the prudent use of antimicrobial agents in human medicine. Off J Eur Commun 2002 (2002/77/EC): L34/13-16.
- De With K, Allerberger F, Amann S, Apfalter P, Brodt HR, Eckmanns T, Fellhauer M, Geiss HK, Janata O, Krause R, Lemmen S, Meyer E, Mittermayer H (+), Porsche U, Prestel E, Reuter S, Sinha B, Strauß R, Wachsler-Fördöd A, Wenisch U, Kern WV: S3-Leitlinie Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaus. Deutsche Gesellschaft für Infektiologie (Federführung). Endfassung vom 15.12.2013. AWMF online.
Datum: 13.05.2014
Quelle: Wehrmedizinische Monatsschrift 2014/3